HIỂU VAI TRÒ CỦA IO TRONG ĐIỀU TRỊ UNG THƯ
Tìm hiểu vai trò của điều trị ức chế điểm kiểm soát miễn dịch trong điều trị Ung thư
Giới thiệu:
Liệu pháp miễn dịch đã cách mạng hóa phương pháp điều trị ung thư, mang lại hy vọng mới cho bệnh nhân mắc các bênh lý khối u ác tính khác nhau. Trong số các phương pháp hứa hẹn nhất là thuốc ức chế điểm kiểm soát miễn dịch (Immune Check-point Inhibitors - ICIs), các thuốc này đã chứng minh hiệu quả đáng kể trong việc tăng cường phản ứng miễn dịch của cơ thể chống lại các tế bào ung thư, qua đó nâng cao chất lượng cuộc sống kéo dài thời gian sống thêm và thêm cơ hội điều trị khỏi bệnh.
Cơ chế hoạt động và ứng dụng lâm sàng
Cơ chế hoạt động của các điểm kiểm soát miễn dịch là con đường điều tiết duy trì khả năng tự dung nạp và điều chỉnh phản ứng miễn dịch để ngăn ngừa tự miễn dịch. Các tế bào khối u thường khai thác các điểm kiểm soát này để tránh sự phát hiện hệ miễn dịch. Thuốc ức chế điểm kiểm soát miễn dịch hoạt động bằng cách chặn các điểm kiểm soát này, do đó các tế bào miễn dịch sẽ giải phóng các chất trung gian miễn dịch và hoạt hóa hệ thống miễn dịch để tấn công các tế bào ung thư một cách hiệu quả hơn.
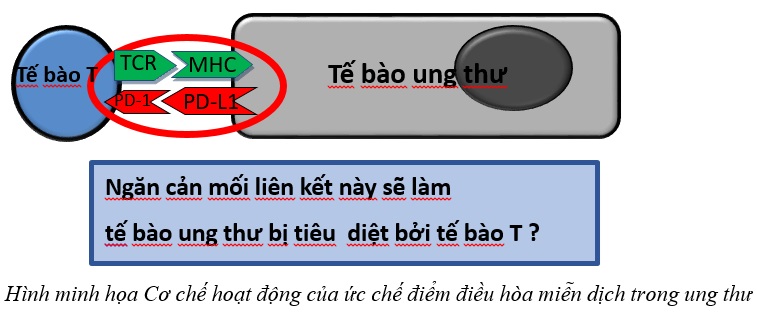
Các điểm kiểm soát miễn dịch phổ biến nhất được các thuốc ICI nhắm mục tiêu là:
- Protein chết theo chương trình 1 (PD-1) nằm trên các tế bào miễn dịch,
- Phối tử PD-L1 nằm trên các tế bào ung thư, hoặc các tế bào mang kháng nguyên
- Protein liên quan đến tế bào lympho T gây độc 4 (cytotoxic T-lymphocyte-associated protein 4 - CTLA-4).
Con đường PD-1 / PD-L1: PD-1 là một thụ thể ức chế miễn dịch biểu hiện trên các tế bào T, các phối tử của nó bao gồm PD-L1 và PD-L2, thường được biểu hiện quá mức trên các tế bào khối u. Liên kết PD-1 với các phối tử ức chế hoạt động của tế bào T, cho phép các tế bào ung thư trốn tránh sự giám sát miễn dịch. ICI nhắm trúng đích PD-1 (ví dụ: nivolumab, pembrolizumab) hoặc PD-L1 (ví dụ: atezolizumab) ngăn chặn sự tương tác này, khôi phục chức năng tế bào T và thúc đẩy sự phá hủy tế bào khối u.
Con đường CTLA-4: CTLA-4 là một thụ thể ức chế khác trên các tế bào T cạnh tranh với thụ thể kích thích CD28 để liên kết với các phân tử B7 trên các tế bào trình diện kháng nguyên. Thuốc trúng đích CTLA-4 (ví dụ: ipilimumab) giúp tăng cường kích hoạt và tăng sinh tế bào T, tăng cường phản ứng miễn dịch chống lại tế bào ung thư.
Ứng dụng lâm sàng ICI đã được phê duyệt để điều trị các bệnh ung thư khác nhau, như ung thư hắc tố, ung thư phổi không tế bào nhỏ, ung thư vú thể tam âm, ung thư cổ tử cung, ung thư biểu mô vẩy đầu cổ, ung thư thực quản, ung thư dạ dày, ung thư gan, ung thư biểu mô tế bào thận... v.v.
Các thuốc ICI đã được chứng minh hiệu quả trong điều trị bệnh ung thư như pembrolizumab và nivolumab, nhắm mục tiêu PD-1, Ipilimumab, Tremelimumab nhắm mục tiêu CTLA-4, hay Atezolizumab và Durvalumab nhắm trúng đích PD-L1.
Những liệu pháp này đã cải thiện đáng kể tỷ lệ khỏi bệnh và chất lượng cuộc sống cho nhiều bệnh nhân mắc ung thư giai đoạn sớm có nguy cơ tái phát cao. Đối với những bệnh nhân mắc các bệnh lý ung thư giai đoạn tiến triển, di căn xa, việc cải thiện khả năng kiểm soát bệnh, kéo dài thời gian sống và cải thiện chất lượng cuộc sống đã được chứng minh qua các thử nghiệm lâm sàng. Ví dụ, ung thư phổi: ICI đã trở thành một phương pháp điều trị tiêu chuẩn cho ung thư phổi không phải tế bào nhỏ, đặc biệt ở những bệnh nhân có biểu hiện PD-L1 cao. Nghiên cứu KEYNOTE 189 ghi nhận kết hợp miễn dịch và hóa trị ở bệnh nhân ung thư phổi không tế bào nhỏ giai đoạn tái phát, di căn giảm 51% nguy cơ bệnh nhân tử vong. Ung thư vú thể tam âm đã được cải thiện tỉ lệ sống lâu dài bằng phương pháp điều trị ức chế điểm kiểm soát miễn dịch với thuốc pembrolizumab với tỉ lệ đáp ứng hoàn toàn trên mô bệnh học là 64,8% và giảm tỉ lệ tái phát và tỉ lệ tử vong một cách có ý nghĩa trong nghiên cứu KEYNOTE 522.
Dấu ấn sinh học dự đoán
Biểu hiện PD-L1 là một trong những dấu ấn sinh học được nghiên cứu nhiều nhất để dự đoán đáp ứng với ICI. Tuy nhiên, biểu hiện của nó có thể không đồng nhất và bị ảnh hưởng bởi các yếu tố khác nhau, làm cho nó trở thành một yếu tố dự đoán không hoàn hảo. Các dấu ấn sinh học khác bao gồm thiếu hụt sửa chữa không phù hợp (dMMR) và gánh nặng đột biến khối u cao (TMB), cả hai đều có liên quan đến phản ứng tốt hơn với ICI.
Định hướng tương lai Tương lai của liệu pháp miễn dịch và ICI nằm ở việc khắc phục những hạn chế hiện tại và mở rộng khả năng ứng dụng của chúng. Các lĩnh vực trọng tâm chính bao gồm: Liệu pháp kết hợp: Kết hợp ICI với các phương pháp điều trị khác, chẳng hạn như liệu pháp nhắm trúng đích, hóa trị hoặc các liệu pháp miễn dịch khác, để nâng cao hiệu quả và khắc phục tình trạng kháng thuốc. Một số điểm kiểm soát miễn dịch mới: Nghiên cứu đang được tiến hành để xác định và nhắm mục tiêu các điểm kiểm soát miễn dịch mới, chẳng hạn như LAG-3, TIM-3 và TIGIT, có thể cung cấp các lựa chọn điều trị bổ sung.
Những tiến bộ trong nghiên cứu bộ gen và dấu ấn sinh học đang mở đường cho các phương pháp tiếp cận cá nhân hóa hơn đối với liệu pháp miễn dịch, điều chỉnh phương pháp điều trị cho từng hồ sơ bệnh nhân.
Kết luận
Các thuốc ức chế điểm kiểm soát miễn dịch là một tiến bộ đáng kể trong điều trị ung thư, mang lại hy vọng mới cho bệnh nhân ung thư trước đây không thể điều trị được. Trong khi những thách thức như irAEs và kháng thuốc vẫn còn, nghiên cứu đang diễn ra nhằm mục đích tinh chỉnh các liệu pháp này, cải thiện lựa chọn bệnh nhân và quản lý các tác dụng phụ hiệu quả hơn. Khi sự hiểu biết của chúng ta về miễn dịch học khối u sâu sắc hơn, tiềm năng của liệu pháp miễn dịch để cách mạng hóa điều trị ung thư tiếp tục phát triển.
Bác sĩ Đào Văn Tú
Khoa Điều trị theo yêu cầu Quán Sứ, Bệnh viện K